10月22日,海南医科大学(海南省医学科学院)邹卫国教授、复旦大学王作云教授、上海六院郑宪友教授和索金龙副研究员合作在《Nature Communications》在线发表了题为“Targeting VGLL4 maintains extracellular matrix homeostasis and mitigates osteoarthritis in a preclinical model”的研究论文。该研究首次揭示了VGLL4-TEAD-SMAD3三元复合物在维持软骨细胞外基质稳态的关键功能,其功能失调导致关节透明软骨纤维化,并通过AAV介导的基因回补策略验证了复合物的治疗潜力。

骨关节炎(Osteoarthritis, OA)是全球范围内最常见的致残性关节疾病,其特征是关节软骨的进行性破坏和细胞外基质的病理性重塑,最终导致透明软骨向纤维软骨转化。细胞外基质是维持软骨功能的核心。然而,调控软骨稳态过程的核心分子机制尚不清晰,目前缺乏能够逆转OA病程的FDA批复的药物。
为了寻找关键的调控因子,研究者首先对骨骼干/祖细胞及人软骨细胞的单细胞测序数据进行了深度挖掘,发现Hippo信号通路中的转录辅因子VGLL4在软骨细胞中特异性高表达,而在损伤软骨及衰老软骨中,表达显著下降。这一现象提示VGLL4可能与软骨的稳态维持及病理进程密切相关。在功能验证中,研究者发现VGLL4在软骨中特异性高表达,而在损伤或衰老软骨中显著下降。通过构建软骨细胞特异性敲除VGLL4的小鼠模型,发现小鼠会自发出现早期骨关节炎表型,并在DMM手术诱导后表现出更严重的软骨破坏及纤维化。转录组分析显示VGLL4缺失引起一系列胶原合成与基质组装相关基因广泛下调。机制研究表明,VGLL4通过其C末端的TDU结构域与TEADs和SMAD3形成三元复合体。结构预测与突变实验证实,TEAD4与SMAD3通过氢键和疏水作用结合,而VGLL4通过π-π堆积与TEAD4稳定结合。破坏任一相互作用界面均导致复合体解体,并丧失促进基质基因表达的功能。为验证其转化价值,研究团队向骨关节炎模型小鼠关节内注射携带Smad3或Vgll4基因的AAV病毒。结果显示,回补野生型基因能有效缓解病情,而回补无法形成三元复合体的突变体则无效。这证明VGLL4-TEAD-SMAD3三元复合体的形成是实现软骨保护作用的必要条件。
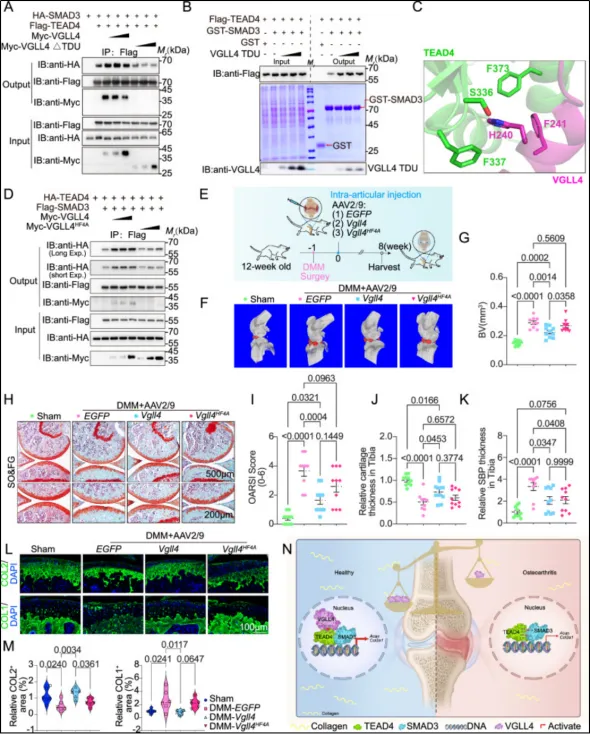
该研究不仅揭示了VGLL4通过连接Hippo与TGF-β通路、协同调控软骨基质基因转录的全新机制,更重要的是明确了VGLL4-TEAD-SMAD3复合体作为一个明确的治疗靶点,为开发针对骨关节炎的精准基因疗法奠定了坚实的理论基础,并提供了极具前景的干预策略。
上海市第六人民医院索金龙副研究员、中国科学院分子细胞科学卓越创新中心王多副研究员为该论文的共同第一作者。海南医科大(海南省医学科学院)邹卫国教授、复旦大学王作云教授、上海市第六人民医院郑宪友教授和索金龙副研究员为该论文的共同通讯作者。该工作受到国家自然科学基金委、中国科学院等单位资助。
原文地址:https://www.nature.com/articles/s41467-025-64361-7